Установлена математическая модель взаимодействия аморфного, некристаллизирующегося, фуллереноподобного углеродсодержащего природного минерала – шунгита и микрокристаллического алюмосиликатного минерала цеолита с водой. Приведены данные о наноструктуре, полученные с помощью сканирующей электронной микроскопии (СЭМ), газовой хроматографии и ИК-спектроскопии (НЭС- и ДНЭС-методы). Измерены средние энергии (∆EH…O) водородных Н…O-связей между молекулами H2O в образцах воды после ее обработки шунгитом и цеолитом. Полученные данные могут быть использованы для изучения взаимодействия природных и синтетических материалов на основе шунгита и цеолита с водой.
Шунгит (пос. Шуньга, Карелия, РФ) и цеолит (мест. Мост, Болгария) относится к новому поколению природных минеральных сорбентов (ПМС). Шунгит – промежуточный продукт между аморфным углеродом и кристаллическим графитом, содержащий углерод (30 масс. %), кварц (45 масс. %) и силикатные слюды (около 20 масс. %).
Цеолиты являются алюмосиликатными минералами натрия, калия или других элементов. Природные цеолиты образуются в условиях высоких температур и давлений при контакте вулканических пород и слоев пепла с щелочными грунтовыми водами.
В качестве ПМС шунгит и цеолит широко применяются в промышленности, в частности в строительстве. Шунгит используется в качестве наполнителя и заменителя кокса в доменном производстве высококремнистого чугуна, при выплавке ферросплавов, в производстве термоустойчивых красок и антипригарных покрытий, а также как наполнитель резины. Шунгитовые породы обладают сорбционными, бактерицидными, каталитическими, восстановительными свойствами, а кроме того, способностью экранировать электромагнитные и радиоизлучения [1]. Эти свойства позволили использовать шунгит для создания различных материалов с наномолекулярной структурой. На основе шунгита созданы электропроводные краски, наполнители полимерных материалов и резин, заменители сажи и технического углерода, бетоны, кирпичи, штукатурные растворы, асфальты. Сорбционные, каталитические и восстановительные свойства шунгита способствовали его использованию в водоподготовке для очистки сточных вод от неорганических и органических веществ (тяжелые металлы, аммиак, нефтепродукты, пестициды, фенолы, поверхностно-активные вещества и др.) [2]. Шунгит является эффективным сорбентом для очистки воды от хлора и хлорорганических веществ (диоксинов, радикалов), обладает бактерицидными свойствами по отношению к патогенной микрофлоре в воде.
Цеолиты благодаря способности поглощать или пропускать через кристаллический каркас молекулы других химических соединений могут использоваться как своеобразные молекулярные сита для разделения смеси газов и жидкостей [3]. Кроме того, цеолиты являются ионообменниками катионного типа, способными извлекать из воды тяжелые металлы и по сравнению с синтетическими смолами обладают повышенной избирательностью к ионам цезия, свинца, кадмия и стронция.
Широкий спектр полезных свойств шунгита и цеолита определяет поиск новых областей практического применения этих минералов, что способствует более глубокому изучению структуры шунгита и цеолита с помощью современных методов анализа. Целью работы являлось исследование структурных свойств шунгита и цеолита и построение математической модели взаимодействия этих минералов с водой.
Методика эксперимента
Материалы
Исследование проводили с образцами шунгита, полученного из Зажогинского месторождения (Карелия, Россия), и алюмосиликата цеолита (Мост, Болгария). Образцы были взяты и проанализированы в твердых пробах в соответствии с национальным стандартом российского Федерального агентства по техническому регулированию и метрологии. Образцы были помещены в герметично закрытые стеклянные пробирки объемом 100 см3 после промывки дистиллированной водой и высушены в тигельной печи, а затем гомогенизированы в гомогенизаторе путем механического шлифования. Для термического разложения образцов шунгита использовали систему СВЧ-нагрева. Другие методы обработки проб включали промывку дистиллированной водой, сушку и гомогенизацию на крестовых ударных мельницах Retsch SK100 (Retsch Co., Германия) и Pulverisette 16 (Fritsch GmbH, Германия).
Аналитические методы
Аналитические методы аккредитованы Институтом геологии рудных месторождений петрографии, минералогии и геохимии (РАН). Образцы были обработаны с помощью различных методов, таких как ICP-OES, GC и SEM.
Оптическая эмиссионная спектрометрия с индуктивно связанной плазмой (ICP-OES)
Минеральный состав шунгита изучали с помощью ICP-OES спектроскопии на спектрометре Agilent ICP 710-OES (Agilent Technologies, США), оборудованном плазменным распылителем (в потоке аргона), детектором MegaPixel CCD (США) и ВЧ-генератором с воздушным охлаждением: спектральный диапазон – 67-785 нм; скорость потока плазмы – 1,5 л/мин; выходная мощность – 700-1500 Вт.
Элементный анализ
Полное количество углерода (Сtotal) в шунгите измеряли в соответствии с ISO 29541 с использованием элементарного анализатора ЦОН-580 (Eltra GmbH, Германия), оснащенного электрической печью и ИК-детектором, при сгорании 200 мг твердого усредненного образца в потоке кислорода при температуре 1500°С.
Просвечивающая электронная микроскопия (ПЭМ)
Структурные исследования проводились с использованием прибора JSM 35 CF (JEOL Ltd., Корея), оснащенного рентгеновским микроанализатором Tracor Northern TN, детектором SE, термомолекулярным насосом и вольфрамовой электронной пушкой (Harpin type W filament, США); рабочее давление – 4-10 Па; увеличение – 300000; разрешение – 3,0 нм; ускоряющее напряжение – 1-30 кВ; размер образца – 60-130 мм.
ИК-спектроскопия
ИК-спектры образцов получены на ИК-спектрометре Brucker Vertex (Brucker, Германия) (спектральный диапазон – средний ИК – 370-7800 cм-1; видимый – 2500-8000 cм-1; разрешение – 0,5 cм-1; точность волнового числа – 0,1 cм-1 на 2000 cм-1) с использованием методов неравновесного энергетического спектра (НЭС) и дифференциального неравновесного энергетического спектра (ДНЭС).
Экспериментальные результаты и их обсуждение
Структурные свойства и состав шунгита и цеолита
Цеолит и шунгит относятся к новому поколению ПМС. Шунгит по структуре представляет собой аллотропную форму метастабильного углерода, находящегося на предграфитовой стадии углефикации [4]. В состав шунгита, кроме углерода, входят SiO2 (57,0 масс. %), TiO2 (0,2 масс. %), Al2O3 (4,0 масс. %), FeO (0,6 масс. %), Fe2O3 (1,49 масс. %), MgO (1,2 масс. %), MnO (0,15 масс. %), К2О (1,5 масс. %), S (1,2 масс. %) (табл. 1). В продукте, полученном при термическом обжиге шунгита (шунгизит) при 1200-1400°С, обнаруживаются в небольших количествах V (0,015 масс. %), B (0,004 масс. %), Ni (0,0085 масс. %), Mo (0,0031 масс. %), Cu (0,0037 масс. %), Zn (0,0067 масс. %), Co (0,00014 масс. %) As (0,00035 масс. %), Cr (0,0072 масс. %), Zn (0,0076 масс. %).
Таблица 1. Химический состав шунгитов Зажогинского месторождения (Карелия), масс. %
| № | Химический элемент, компонент | Содержание, масс. % |
| 1 | С | 30,0 |
| 2 | SiO2 | 57,0 |
| 3 | TiO2 | 0,2 |
| 4 | Al2O3 | 4,0 |
| 5 | FeO | 0,6 |
| 6 | Fe2O3 | 1,49 |
| 7 | MgO | 1,2 |
| 8 | MnO | 0,15 |
| 9 | CaO | 0,3 |
| 10 | Na2O | 0,2 |
| 11 | K2O | 1,5 |
| 12 | S | 1,2 |
| 13 | B | 0,04 |
| 14 | V | 0,015 |
| 15 | Co | 0,00014 |
| 16 | Cu | 0,0037 |
| 17 | Mo | 0,0031 |
| 18 | As | 0,00035 |
| 19 | Ni | 0,0085 |
| 20 | Cr | 0,0072 |
| 21 | Zn | 0,0076 |
| 22 | H2O | 1,5 |
Цеолит – алюмосиликатный минерал, состоящий из алюмосиликатного каркаса с щелочноземельными металлами натрия, калия или других элементов. Кристаллическая структура цеолитов образована тетраэдрами [AlO4]2- и [SiO4]2-, объединенными общими вершинами, отрицательные заряды которых компенсируются катионами (H+, Na+, K+, Ca2+, NH4+), в большинстве случаев способными к катионному обмену в водных растворах. В промежутках кристаллического каркаса расположены гидратированные положительные ионы щелочных и щелочноземельных металлов – натрия, калия, кальция, реже магния, бария, стронция, компенсирующих заряд каркаса, и молекулы воды. Тетраэдры [AlO4]2- и [SiO4]2- образуют вторичные структурные единицы, такие как пятичленные кольца, шестичленные кольца, усеченные октаэдры и др., формирующие каркас цеолита (рис. 1). Кристаллический каркас из алюмосиликатов включает взаимодействие каналов и полостей, образующих пористую структуру с формированием «молекулярных пор» размерами 0,3-1 нм. Размеры каналов достаточны для проникновения в них органических молекул и катионов, а суммарный объем их вместе с порами достигает 50%. Средний размер кристаллической решетки цеолита может варьировать в диапазоне от 0,5 до 30 мкм.
![Трехмерная кристаллическая структура цеолита типа ZSM-5 формулы Na2[Al2Si96-nO192]∙16H2O (n=3-5)](/articles/ccc-1-2019/21-27-web-resources/image/Рис1.jpg)
Общая химическая формула цеолитов может быть представлена в следующем виде:
Ме2/n[(Аl2O3)x(SiO2)y].zН2O, (1)
где Me – катион щелочного металла; n – его валентность; x, γ – мольные соотношения оксидов кремния и алюминия в каркасе цеолита, указывающие на количество катионообменных позиций в структуре (y=2–∞); z – количество молекул воды.
Известно более 30 видов природных цеолитов, но лишь часть из них образует крупные месторождения (80% концентратов), удобные для промышленной переработки. Наиболее распространены природные цеолиты:
• шабазит (Ca,Na2)[Al2Si4O12]∙6H2O с размерами ячейки 0,37-0,50 нм;
• морденит (Ca,Na2,K2)[Al2Si10O24].7H2O с размерами ячейки 0,67-0,70 нм;
• клиноптилолит (Na2,K2,Ca)[Al2O3.10SiO2].8H2O с размерами ячейки 0,75-0,82 нм.
Синтетические цеолиты имеют строение и кристаллическую структуру, аналогичные природным цеолитам:
• цеолиты типа А относятся к низкокремнистым формам: в них отношение SiO2:Al2O3 не превышает 2;
• цеолиты типа X имеют отношение SiO2:Al2O3, которое может изменяться от 2,2 до 3,3;
• цеолиты типа Y характеризуются соотношением SiO2:Al2O3 в пределах от 3,1 до 6. При увеличении этого показателя повышается кислотостойкость цеолитов. Размеры пор, определяющих избирательность цеолитов, изменяются от 0,0003 до 0,0009 мкм.
Элементный состав анализируемого цеолита из местечка Мост (Болгария) аналогичен таковому для шунгита (табл. 2), за исключением углерода, который не встречается в цеолите, и некоторых других элементов. Количества основных элементов (SiO2, TiO2, Al2O3, FeO, Fe2O3, MgO, CaO, Na2O, K2O, S),
составляющие эти минералы, отличаются от шунгита: в цеолите их содержание выше, чем у шунгита, за исключением TiO2 и K2O, содержание которых в цеолите снижено (табл. 2). Содержание микроэлементов V (0,0272%), Co (0,0045%), Cu (0,0151%), Mo (0,0012%), As (0,0025%), Ni (0,0079%), Zn (0,1007%), Ba (0,0066%) и Cr (0,0048%) увеличено в цеолите по сравнению с шунгитом (табл. 2).
Таблица 2. Химический состав цеолита (Мост, Болгария), масс. %
| № | Химический элемент, компонент | Содержание, масс. % |
| 1 | SiO2 | 22,14 |
| 2 | TiO2 | 0,01 |
| 3 | Al2O3 | 17,98 |
| 4 | FeO | 23,72 |
| 5 | Fe2O3 | 1,49 |
| 6 | MgO | 14,38 |
| 7 | MnO | 0,61 |
| 8 | CaO | 0,36 |
| 9 | Na2O | 0,5 |
| 10 | K2O | 0,4 |
| 11 | S | 0,32 |
| 12 | P2O5 | 0,06 |
| 13 | Ba | 0,0066 |
| 14 | V | 0,0272 |
| 15 | Co | 0,0045 |
| 17 | Cu | 0,0151 |
| 18 | Mo | 0,0012 |
| 19 | As | 0,0025 |
| 20 | Ni | 0,0079 |
| 21 | Pb | 0,0249 |
| 22 | Sr | 0,0021 |
| 23 | Cr | 0,0048 |
| 24 | Zn | 0,1007 |
| 25 | H2O | 1,43 |
Физико-химические свойства шунгита и цеолита достаточно хорошо изучены [5, 6]. Плотность шунгита составляет 2,1-2,4 г/см3; пористость – до 5%; прочность на сжатие – 100-120 МПа; коэффициент электропроводности – 1500 См/м; коэффициент теплопроводности – 3,8 Вт/м.К, адсорбционная емкость – 15-20 м2/г. Плотность цеолита – 1,7-2,1 г/см3; пористость – 51% объема каркаса; адсорбционная емкость 5 м2/г; средний размер пор – 4-6 А; твердость по шкале Мооса – 4-5.
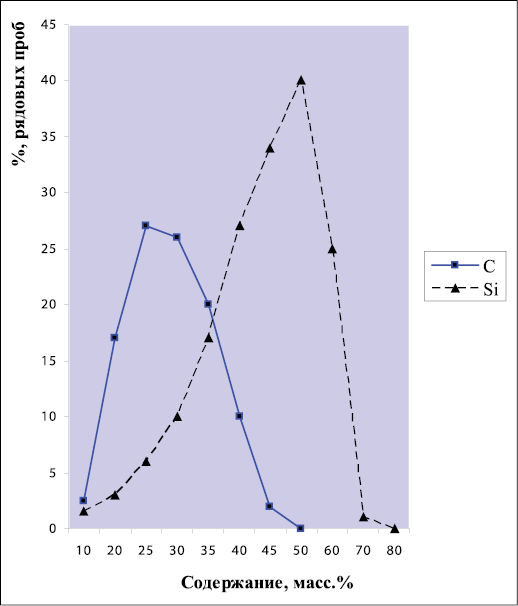
Шунгиты и цеолиты различаются по составу минеральной основы (алюмосиликатной, кремнистой), а шунгиты дополнительно – по количеству шунгитового углерода. Шунгиты с силикатной минеральной основой подразделяются на малоуглеродистые (до 5 масс. % С), среднеуглеродистые (5-25 масс. % С) и высокоуглеродистые (25-80 масс. % С) [7]. Сумма (C+Si) в шунгитах Зажогинского месторождения находится в пределах 83-88 масс. % (рис. 2). Молярные соотношения оксидов кремния и алюминия в алюмосиликатном каркасе цеолита составляют 2-3 ед.
Исследования ультратонких шлифов шунгита методом просвечивающей (трансмиссионной) электронной микроскопии (ПЭМ) и растровой электронной микроскопии (РЭМ) в поглощенных и обратнорассеянных электронах [8] показали, что шунгитовый углерод равномерно распределен в силикатном каркасе из мелкодисперсных кристаллов кварца размерами 1-10 мкм.
Согласно результатам исследований, углеродистое вещество шунгита является продуктом высокой степени карбонизации углеводородов. Его элементный состав (масс. %): С – 98,6-99,6; Н – 0,15-0,5; (Н+О) – 0,15-0,9. При практически постоянном элементном составе углеродистого вещества шунгита наблюдалось непостоянство его структур – молекулярной, надмолекулярной, поверхностной и пористой [9]. Шунгитовый углерод представлен полыми, многослойными фуллереноподобными сферическими глобулами диаметром 10-30 нм, содержащими пакеты плавно изогнутых углеродных слоев, охватывающих нанопоры. Структура глобулы устойчива относительно фазовых переходов шунгитового углерода в другие аллотропные формы. Фуллереноподобные глобулы могут содержать от нескольких десятков до нескольких сотен атомов углерода и различаться по форме и размерам [10].
Углеродистое вещество шунгитов обладает структурной анизотропией и проявляет существенное увеличение диамагнетизма при пониженных температурах, характерное для кристаллов, образованных молекулами фуллеренов (фуллериты). Фуллериты являются молекулярными кристаллами с гранецентрированной кубической (ГЦК) решеткой размером 1,42 нм, числом ближайших соседей – 12 и расстоянием между ближайшими соседями – 1 нм. Плотность фуллерита составляет 1,7 г/см3, что несколько меньше плотности и шунгита (2,1-2,4 г/см3) и графита (2,3 г/см3). Молекулы фуллеренов могут содержать 24, 28, 32, 36, 50, 60, 70 и т.д. атомов углерода. Фуллерены с количеством углеродных атомов n<60 являются неустойчивыми. Высшие фуллерены, содержащие большее число атомов углерода (n<400), образуются в незначительных количествах и часто имеют довольно сложный изомерный состав [11]. В углеродистом веществе шунгитовых пород выявлены фуллерены (С60, С70, С74, С76, С84 и др.), а также фуллереноподобные структуры – как обособленные, так и связанные с минералами [12].
Изучение взаимодействия шунгита и цеолита с водой
Методы изучения структуры шунгита и цеолита включают СЭМ, РЭМ, дифракционный анализ, ИК-спектроскопию и др. ИК-спектры могут быть получены, как правило, с количеством 0,5-3 мг образца, т.е. значительно меньше, чем требуется для ЯМР. В отличие от ЯМР измерение ИК-спектров возможно для твердых соединений, что позволяет исследовать даже нерастворимые твердые вещества и минералы.
Посредством измерения ИК-спектров в области вибрационных колебаний кристаллической решетки шунгита и цеолита можно получить информацию о составе минерала, о структуре силикатного/алюмосиликатного каркаса и соотношении C/SiO2 или SiO2/Al2O3 в кристаллической решетке минерала, а также о характере поверхности структурных групп, которые являются центрами адсорбции и каталитически активных групп [13].
Поглощение электромагнитных волн в инфракрасной области (400-4000 нм) обусловлено колебательным движением молекул, связанным с изменением длин химических связей (валентных колебаний, v) или углов связей между атомами (деформационные колебания, δ). ИК-спектр углерода, содержащего органические соединения, находится в диапазоне от 400-4000 см-1 и позволяет достаточно точно идентифицировать эти соединения. Тем не менее часто интерпретация природных углеродсодержащих минералов затруднена из-за их многокомпонентного состава и, как следствие, многочисленных полос колебаний в образцах. Кроме того, количество полос поглощения в ИК-спектрах сложных соединений может отличаться от числа нормальных колебаний молекул из-за появления дополнительных полос обертонов, составляющих частот и перекрывания линий из-за резонанса Ферми.
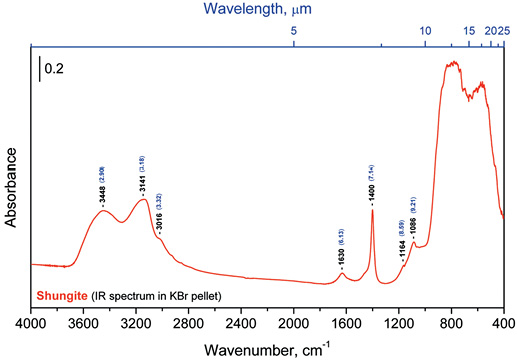
Изучение шунгита методом ИК-спектроскопии показало присутствие 7 основных полос в ИК-спектре шунгита, зарегистрированных при 2,90; 3,18; 3,32; 6,13; 7,14; 8,59; 9,21 мкм, или 3448; 3141; 3016; 1630; 1400; 1164 и 1086 см-1, которые соответствуют колебаниям различных групп углеродсодержащих органических соединений в шунгите (рис. 3).
Средняя ИК-область является наиболее информативной и отмечена как фундаментальная. В свою очередь, эта область подразделяется на область «отпечатков пальцев» (700-1500 см-1) и область характеристических полос (1500-4000 см-1).
При интерпретации ИК-спектров наиболее информативными являются область при 2500-1500 см-1 и область при 4000-2500 см-1. Анализ первой из них позволяет определить присутствие в образце ненасыщенных углеродсодержащих соединений: С=С, C≡C, C=O, C=N, C≡N, а также ароматических и гетероароматических соединений. Полосы поглощения в области 4000-2500 см-1 могут идентифицировать функциональные группы (O–H, N–H, S–H и др.) и различные виды связей (Csp3–H, Csp2–H, Csp–H, (O=)C–H).
ИК-спектры органических соединений можно разделить на три основных диапазона: 1) 4000-2500 см—1 – область валентных колебаний одинарных ковалентных связей X–H: O–H, N–H, C–H, S–H; 2) 2500-1500 см-1 – область валентных колебаний кратных связей X=Y: X≡Y, С=С, С=О, C=N, C≡C, C≡N; 3) 1500-500 см-1 – область валентных колебаний одинарных ковалентных связей X–Y: С–С, С–N, C–O и деформационных колебаний одинарных ковалентных связей X–H: C–H, O–H, Н–Н.
В субдиапазоне (700-1500 см-1) находятся полосы поглощения скелета органических молекул, содержащих C–C, С–О и С–N-связи (для этого диапазона нехарактерны колебания, принадлежащие отдельным связям). Характер ИК-спектра в этом диапазоне частот значительно варьирует в зависимости от небольших различий в ИК-спектрах органических соединений, и каждое соединение имеет свой уникальный отличительный набор полос поглощения. Он может быть использован для идентификации молекул, имеющих ту же функциональную группу.
В спектральном диапазоне 1500-4000 см-1 находятся все колебания основных функциональных групп органических соединений. Эти группы действуют изолированно и независимо от остальной части молекулы, поскольку их частоты поглощения изменяются незначительно при переходе от одного соединения к другому. Характеристическими могут быть полосы, соответствующие как валентным, так и деформационным колебаниям.
Поглощение в области 1400-1300 см-1 и 700 см-1 обусловлено деформационными колебаниями CH3- и CH2-групп. Валентные колебания терминальной связи С=С соответствуют средней интенсивности полосы при 1640 см-1. Положение полосы поглощения CH2-группы при 800-700 см-1 зависит от длины углеродной цепи и используется для обнаружения органических соединений, содержащих полиметиленовую цепь. В областях 3095-3010; 2975; 3040-3010 см-1 находятся валентные колебания С–Н-ароматических, гетероароматических, небольших циклических и галогенированных алкильных групп.
Основной диапазон характерных полос органических соединений изменяется в диапазоне от 3100 до 3000 см-1 для H–C; N–Н; O–Н-связей; 3100-2800 см-1 – для С–Н; -CH3-связей; 3040-3010 см-1 – для = CH-связи; 1750-1700 см—1 – для C=O-связи; 1690-1630 см-1 – для C=N-связи; 1670-1620 см-1 – для C=C-связи; 1420-1410 см-1 – для CH2=CH-связи; 1310-1295 см-1 – для -СН=СН-связи; 1250-1200 см-1 – для Csp3–Csp3-связи; 1260-1000 см-1 для С–О-связи; 1220-1020 см-1 – для С-N-связи; 1400-1300 см-1 – для CH2-связи; 1640-1600 см-1 – для С=C–С=C или C=C–С=O-связей; 1060-1950 см-1 для сопряженных двойных С=С=С-связей.
Поглощение в области 3000-2800 см-1 детектируется в виде комплексной полосы поглощения. Положение полос в этой области сохраняется во всех типах алифатических углеводородов. Интенсивность полосы поглощения в этой области зависит от количества CH2- и CH3-групп в молекуле. Накопление CH2-групп повышает интенсивность полосы поглощения при 3000-2800 см-1, в то время как интенсивность полосы СН3-группы мало изменяется. Это свойство используется для количественного анализа углеводородов в анализируемых образцах методом ИК-спектроскопии. Таким образом, состав шунгита является многокомпонентным и сложным; этот минерал содержит в своем составе многие функциональные группы органических соединений с различными типами химических связей, что обусловлено многокомпонентным органическим составом.
При построении модели взаимодействия шунгита и цеолита с водой удобным методом является построение энергетического спектра воды, который дает информацию о средней энергии водородных связей. Экспериментальным путем было установлено, что при испарении капли воды угол смачивания (θ) уменьшается дискретно до нуля, причем диаметр капли изменяется незначительно. Путем измерений этого угла через равные интервалы времени определяется функциональная зависимость f(θ), которая обозначается спектром состояния воды. Для практических целей за счет измерения спектра состояния воды можно получить информацию об усредненном значении энергии водородных связей в пробе воды. Для этого используется модель У. Лукка, рассматривающая воду как ассоциированную жидкость, состоящую из О–Н…О–Н-групп [14]. Большая часть этих групп определяется энергией водородных связей (—E), а остальные свободны (E = 0). Функция распределения по энергиям f(E) измеряется в электронвольтах (эВ-1) и изменяется с температурой.
Для практических расчетов функции f(E) используется экспериментальная зависимость между поверхностным натяжением воды (θ) и энергией водородных связей между ее молекулами (E):
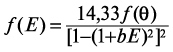 , (2)
, (2)
где b = 14,33 эВ—1; θ = arcos(1 – bE).
Процесс характеризуется неравновесным испарением капель воды, поэтому используется термин «неравновесный энергетический спектр воды» (НЭС).
Разность ∆f(E)=f (пробы воды) – f (контрольной пробы воды) характеризует «дифференциальный неравновесный энергетический спектр воды» (ДНЭС).
ДНЭС измеряется в миллиэлектронвольтах (мэВ) и является мерой структурных изменений воды в результате внешних воздействий.
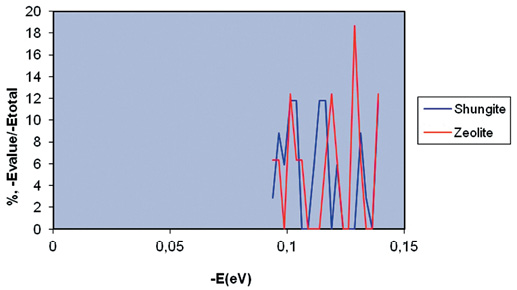
Исследование методами НЭС и ДЭС образцов воды, полученной после 3-дневного контакта шунгита и цеолита с деионизированной водой, может также дать информацию о возможном числе водородных связей в ассоциатах воды, состоящих из О–Н…О–Н-групп, и распределении молекул H2O по энергиям водородных связей (-Evalue) относительно общей энергии водородных связей (Etotal) в образцах воды (табл. 3).
Taблица 3. Энергии водородных связей между молекулами Н2О в образцах воды, полученных ДНЭС-методом*, после 3-дневного контакта с шунгитом и цеолитом
| -Е(eV) x-ось | Шунгит, %, [(-EValue)/ (-Etotal value)] | Цеолит, %, [(-EValue)/ (-Etotal value)] | -Е(eV) x-ось | Шунгит, %, [(-EValue)/ (-Etotal value)] | Цеолит, %, [(-EValue)/ (-Etotal value)] |
| 0,0937 | 2,85 | 6,3 | 0,1187 | 0 | 12,4 |
| 0,0962 | 8,8 | 6,3 | 0,1212 | 5,9 | 6,3 |
| 0,0987 | 5,9 | 0 | 0,1237 | 0 | 0 |
| 0,1012 | 11,8 | 12,4 | 0,1262 | 0 | 0 |
| 0,1037 | 11,8 | 6,3 | 0,1287 | 0 | 18,7 |
| 0,1062 | 0 | 6,3 | 0,1312 | 8,8 | 6,3 |
| 0,1087 | 0 | 0 | 0,1337 | 2,85 | 0 |
| 0,1112 | 5,9 | 0 | 0,1362 | 0 | 0 |
| 0,1137 | 11,8 | 0 | 0,1387 | 11,8 | 2,4 |
| 0,1162 | 11,8 | 6,3 | – | – | – |
*Показано распределение значений [(-Evalue)/(-Etotal value)], %, молекул H2O в соответствии с энергиями водородных связей (-Evalue) относительно общей энергии водородных связей (Etotal) в образцах воды
Исследования образцов воды после 3-дневного контакта шунгита и цеолита с деионизированной водой методом ДНЭС показали значения средней энергии (∆EH…O) водородных Н…О-связей между молекулами H2O, составляющие +0,0025±0,0011 эВ для шунгита и -1,2±0,0011 эВ для цеолита. Для контрольного образца деионизированной воды эта величина составляет -0,1162 эВ. Данная разница в значениях ∆EH…O между шунгитом и цеолитом свидетельствует о различии механизмов взаимодействия этих минералов с водой, обусловленных различным компонентным составом, структурой (пористость, плотность, адсорбционная емкость).
Полученные результаты свидетельствуют о реструктуризации значений энергий водородных связей между индивидуальными молекулами H2O cо статистически достоверным увеличением локальных максимумов в ДНЭС-спектрах. Так, для значения 0,1387 эВ существует локальный максимум с положительным значением энергии для шунгита и цеолита.
ДНЭС-спектры водных растворов, содержащие катионы Ca2+ в концентрации 0,1 моль/л, обладали локальным максимумом энергии при -0,1100 эВ и локальным минимумом при -0,1000 эВ. ДНЭС-спектры образцов воды после контакта с шунгитом обладают локальным максимумом энергии при -0,1137 эВ и локальным минимумом при -0,0987 эВ. При изменении температуры воды средняя энергия водородных H…O-связей в молекулах Н2О изменяется, что приводит к перераспределению молекул Н2О по энергиям в ДНЭС-спектрах [15]. По данным экспериментальным зависимостям распределения значений [(-Evalue)/(-Etotal value)], %, молекул H2O в соответствии с энергиями водородных связей (-Evalue) относительно общей энергии водородных связей (Etotal) в образцах воды построена математическая модель взаимодействия этих минералов с водой (рис. 4).
Выводы:
Фуллеренсодержащий природный минерал шунгит и микропористый микрокристаллический алюмосиликатный минерал цеолит имеют сложную многокомпонентную структуру. Эффективность использования этих природных минералов обусловлена обширным спектром ценных свойств (сорбционные, каталитические, восстановительные, электропроводные), экологичностью, невысокой стоимостью материалов на основе шунгита и технологий его получения и обработки, а также наличием обширной отечественной сырьевой базы. В результате исследований установлена математическая модель, описывающая взаимодействие этих минералов с водой. Это позволяет понять, как эти минералы взаимодействуют с молекулами Н2О, для объяснения физико-химических и адсорбционных свойств этих минералов.
УДК 553.9 (470.22)
И. ИГНАТОВ, доктор наук Европейской академии естественных наук (Германия), профессор, директор Научно-исследовательского центра медицинской биофизики, София, Болгария; О.В. МОСИН, канд. хим. наук, научный сотрудник Московского государственного университета прикладной биотехнологии
Ключевые слова: шунгит, цеолит, наноструктура, фуллерены, ИК-спектроскопия, ДНЭС
Keywords: shungite, zeolite, nanostructure, fullerene, IR-spectroscopy, DNES
Библиографический список
1. Mosin O.V., Ignatov I. The structure and compositions of natural carbonaceous fullerene containing mineral shungite // International Journal of Advanced Scientific and Technical Research. V. 3. № 11-12, 2013, p. 9-21.
2. Мосин О.В. Природный нанотехнологический минерал в водоподготовке // Нанотехнологии, экология, производство, № 5(12), 2011, с. 110-117.
3. Мосин О.В., Игнатов И. Природный фуллеренсодержащий минерал шунгит в производстве строительных материалов // Строительные материалы, оборудование, технологии XXI века, № 12(179), 2013, с. 28-31.
4. Volkova I.B., Bogdanov M.V. Petrology and genesis of the Karelian shungite-high rank coal // Int. J. Coal Geol. V. 6, 1986, p. 369-379.
5. Парфенева Л.С., Волконская Т.И., Тихонов В.В. Теплопроводность, теплоемкость и термоэдс шунгитового углерода // Физика твердого тела. Т. 36. № 4, 1994, с. 1150-1153.
6. Мосин О.В., Игнатов И. Состав и структурные свойства фуллеренсодержащего минерала шунгита // Нано- и микросистемная техника. Т. 1, 2013, с. 32-40.
7. Медведев П.В., Ромашкин А.Е., Филиппов М.М. Природа исходного органического вещества и особенности микроструктуры кремнистых шунгитовых пород / в кн. «Геология и полезные ископаемые Карелии». – Петрозаводск: КарНЦ РАН, вып. 10, 1998, с. 120-128.
8. Мосин О.В. Новый природный минерал шунгит в водоподготовке // С.О.К. (Сантехника, отопление, кондиционирование), № 3, 2012, с. 26-30.
9. Юшкин Н.П. Глобулярная надмолекулярная структура шунгита: данные растровой туннельной микроскопии // Доклад Академии наук CCCP, т. 337, № 6, 1994, с. 800-803.
10. Мосин О.В., Игнатов И. Структура и свойства фуллеренсодержащего минерала шунгита // Наноматериалы и нанотехнологии, № 2, 2012, с. 25-36.
11. Резников В.А., Полеховский Ю.С. Аморфный шунгитовый углерод – естественная среда образования фуллеренов // Письма в ЖТФ, т. 26, вып. 15, 2000, с. 94-102.
12. Голубев Е.А. Локальные надмолекулярные структуры шунгитового углерода // Труды международного симпозиума «Углеродсодержащие формации в геологической истории». – Петрозаводск: Изд-во Карельского НЦ РАН, 2000, с. 106-110.
13. Ignatov I., Mosin O.V. The structure and composition of carbonaceous fullerene containing mineral shungite and microporos crystalline alumosilicate mineral zeolite // Nanotechnology Research and Practice. V. 1, № 1, 2014, p. 30-42.
14. Ignatov I., Mosin O.V. Structural mathematical models describing water clusters // Journal of Mathematical Theory and Modeling. V. 3, № 11, 2013, p. 72-87.
15. Ignatov I., Mosin O.V. The Structure and Composition of Carbonaceous Fullerene Containing Mineral Shungite and Microporous Crystalline Aluminosilicate Mineral Zeolite. Mathematical Model of Interaction of Shungite and Zeolite with Water Molecules // Advances in Physics Theories and Applications. V. 28, 2014, p. 10-21.