В статье показано, что движущей силой процесса гидратации цемента является разность теплот гидратации и диспергирования зерен цемента, а движущей силой процесса твердения – разность между объемными концентрациями цемента в гидратированном и исходном состоянии. Образование нанодисперсных продуктов гидратации обусловлено протонированием приповерхностных слоев зерен цемента и расклинивающего разрушения поверхностного слоя образующимися первичными молекулами Ca(OH)2 и других гидратированных соединений.
УДК 691
В.А. ЛОТОВ, доктор техн. наук, профессор, Томский политехнический университет
Ключевые слова: гидратация, твердение, цемент, клинкер, минерал, вяжущая система, диспергирование
Keywords: hydration, hardening, cement, clinker, mineral, binding system, dispersion
Выявление механизмов гидратации и твердения цемента имеет исключительно важное значение для понимания процессов превращения клинкерных минералов сначала в коллоидное или нанодисперсное состояние, а затем снова в кристаллическое состояние. Это понимание необходимо для осознанного и обоснованного выбора внешнего энергетического воздействия на систему «цемент – вода», особенно на ранней стадии гидратации цемента, когда начинают развиваться стартовые процессы формирования структуры и прочности цементного камня. Выбор этих воздействий базируется на использовании уравнения Гиббса, являющегося выражением объединенного уравнения первого и второго законов термодинамики:
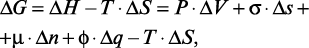
где 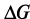 ,
, 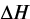 ,
, 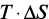 – соответственно, свободная энергия, энтальпийный и энтропийный факторы системы «цемент – вода»;
– соответственно, свободная энергия, энтальпийный и энтропийный факторы системы «цемент – вода»; 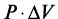 – работа, совершаемая системой при изменении объема, или энергия, необходимая для производства этого изменения;
– работа, совершаемая системой при изменении объема, или энергия, необходимая для производства этого изменения; 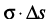 – работа, совершаемая системой при образовании новой поверхности, или энергия, выделяемая или поглощаемая при производстве этого изменения;
– работа, совершаемая системой при образовании новой поверхности, или энергия, выделяемая или поглощаемая при производстве этого изменения; 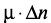 – работа, совершаемая системой, или энергия, выделяемая или поглощаемая при образовании новых химических соединений и взаимопревращений количества вещества в системе, а также изменений ее фазового состава;
– работа, совершаемая системой, или энергия, выделяемая или поглощаемая при образовании новых химических соединений и взаимопревращений количества вещества в системе, а также изменений ее фазового состава; 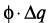 – работа, совершаемая системой при изменении ее электрического потенциала и количества электричества в процессе изменения ионного состава жидкой или твердой фазы, при диспергировании и образовании новой поверхности.
– работа, совершаемая системой при изменении ее электрического потенциала и количества электричества в процессе изменения ионного состава жидкой или твердой фазы, при диспергировании и образовании новой поверхности.
Действие составляющих энтальпийного фактора проявляется сразу после соприкосновения цемента с водой, при котором резко снижается поверхностное натяжение твердой фазы, сопровождаемое выделением теплоты смачивания, инициирующей развитие реакций гидролиза C3S. Обменное разложение веществ водой приводит к смещению равновесия в ионном составе диссоциированных молекул воды за счет активного связывания гидроксилионов при образовании гидроксида кальция и увеличения концентрации ионов водорода (протонов). Реакции гидролиза являются своеобразным энергетическим толчком для начала развития процессов гидратации цемента.
В начальный период гидратации образуются частицы молекулярного уровня дисперсности (1-5 нм) [1], состоящие не менее чем из трех молекул, когда они приобретают свойства фазы. Частицы такого уровня дисперсности при различном химическом составе имеют общий признак – чрезвычайно развитую поверхность, которая составляет 350-450 м2/г [2]. При истинной плотности первичных продуктов гидратации 1,5-2,2 г/см3 среднеповерхностный размер частиц составляет 6-11 нм.
Образование первичных гидратированных частиц нанодисперсного размера и последующего их объединения за счет срастания в условиях появляющегося стесненного состояния является наиболее общим признаком проявления вяжущих свойств для всех вяжущих систем. С момента объединения первичных частиц начинается формирование сначала коагуляционной, а затем и кристаллизационной структуры цементного камня.
Образование первичной нанодисперсной системы при гидратации цемента подтверждается и характером термокинетических кривых (рис. 1). Первый, наиболее интенсивный пик тепловыделения, обусловлен уменьшением свободной поверхностной энергии твердой фазы и выделением теплоты смачивания. Свой вклад в это тепловыделение вносят процессы гидролиза C3S, гидратации других минералов и образования ионов гидроксония по схеме:
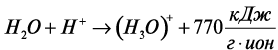 .
.
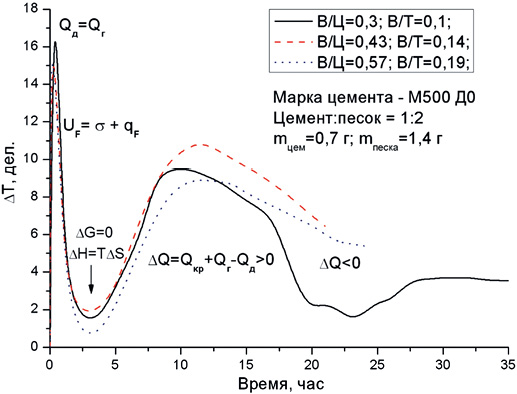
Длительность этого тепловыделения зависит от массы смачиваемой навески цемента и составляет примерно 1 ч, что сопоставимо с длительностью начальных сроков схватывания цемента. Начало схватывания цементного теста обусловлено появлением нанодисперсных гидратированных частиц, которые связывают значительную часть воды затворения, что проявляется в увеличении пластичности цементного теста и его пластической прочности. В период до конца сроков схватывания происходит адсорбционное связывание всей свободной воды, в результате чего система «цемент – вода» приобретает твердообразное состояние и значительную прочность. Движущая сила реакций взаимодействия клинкерных минералов с водой предопределяется величиной суммарного теплового эффекта двух составляющих: теплового эффекта гидратации 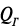 и теплового эффекта разрушения и диспергирования кристаллической решетки минералов
и теплового эффекта разрушения и диспергирования кристаллической решетки минералов 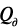 :
:
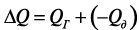 .
.
Теплота гидратации является положительной, т.к. образование связи между двумя ионами всегда сопровождается уменьшением энтальпии (экзотермический процесс). Процесс разрушения и диспергирования кристаллической решетки, сопровождающийся разрывом связей в кристалле, всегда связан с поглощением тепла (эндотермический процесс), и величина 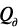 будет отрицательной.
будет отрицательной.
Если 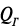 >
> 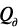 , то
, то 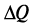 > 0 и избыток тепла расходуется на повышение температуры системы «цемент – вода», что мы и наблюдаем при смачивании цемента водой. При диспергировании кристаллов тепло, затрачиваемое на разрушение кристаллической решетки, превосходит теплоту гидратации
> 0 и избыток тепла расходуется на повышение температуры системы «цемент – вода», что мы и наблюдаем при смачивании цемента водой. При диспергировании кристаллов тепло, затрачиваемое на разрушение кристаллической решетки, превосходит теплоту гидратации 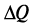 < 0, и температура системы понижается. Единство и противоположность процессов гидратации и диспергирования проявляется в характере первого пика кривой тепловыделения, в котором после интенсивного выделения тепла в первые 4-5 мин. (масса навески цемента – 1 г) начинают преобладать процессы, связанные с затратой тепла на диспергирование, и это тепло практически полностью поглощается системой «цемент – вода» в течение 50 мин., в результате чего общая продолжительность этого пика тепловыделения составляет около 1 ч. Однако процессы диспергирования на этом не заканчиваются и продолжаются в индукционном периоде гидратации за счет дополнительного забора тепла у системы, температура которой снижается на 0,2-0,4°С по сравнению с начальной температурой сухого цемента. Практически горизонтальный характер кривой тепловыделения в индукционном периоде свидетельствует о равенстве тепловых эффектов гидратации и диспергирования (ΔH=TΔS, ΔG=0 – состояние равновесия), и именно в этом периоде образуется значительное количество первичных нанодисперсных продуктов гидратации цемента.
< 0, и температура системы понижается. Единство и противоположность процессов гидратации и диспергирования проявляется в характере первого пика кривой тепловыделения, в котором после интенсивного выделения тепла в первые 4-5 мин. (масса навески цемента – 1 г) начинают преобладать процессы, связанные с затратой тепла на диспергирование, и это тепло практически полностью поглощается системой «цемент – вода» в течение 50 мин., в результате чего общая продолжительность этого пика тепловыделения составляет около 1 ч. Однако процессы диспергирования на этом не заканчиваются и продолжаются в индукционном периоде гидратации за счет дополнительного забора тепла у системы, температура которой снижается на 0,2-0,4°С по сравнению с начальной температурой сухого цемента. Практически горизонтальный характер кривой тепловыделения в индукционном периоде свидетельствует о равенстве тепловых эффектов гидратации и диспергирования (ΔH=TΔS, ΔG=0 – состояние равновесия), и именно в этом периоде образуется значительное количество первичных нанодисперсных продуктов гидратации цемента.
Взаимосвязанное протекание процессов гидратации и диспергирования цемента приводит к увеличению полной свободной поверхностной энергии системы (UF), которая складывается из энергии Гиббса (единицы поверхности) и скрытой теплоты образования единицы новой поверхности [3]:
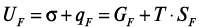 ,
,
где σ – удельная свободная поверхностная энергия, 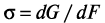 ; GF – энергия Гиббса единицы поверхности; qF – скрытая теплота образования единицы новой поверхности; SF – избыточная энтропия единицы поверхности; T – температура.
; GF – энергия Гиббса единицы поверхности; qF – скрытая теплота образования единицы новой поверхности; SF – избыточная энтропия единицы поверхности; T – температура.
Образование первичных нанодисперсных продуктов имеет исключительно важное значение для стабильного развития во времени процесса гидратации цемента, т.к. при диспергировании увеличивается степень беспорядка в системе и течение процесса гидратации обеспечивается энтропийным фактором. В то же время, если бы течение процесса гидратации цемента обеспечивалось только энтропийным фактором, то наблюдалось бы значительное уменьшение температуры системы. В действительности такое явление не наблюдается, и после некоторого снижения температуры системы в индукционном периоде (преобладание энтропийного фактора), через 4-6 ч после соприкосновения цемента с водой температура системы вновь начинает увеличиваться за счет выделения тепла при объединении первичных частиц в более крупные и стабильные агрегаты, а также тепла, выделяющегося при взаимодействии диполей и ионов воды с негидратированной поверхностью частиц клинкерных минералов (преобладание энтальпийного фактора).
Соотношение значений энтальпийного и энтропийного факторов в системе «цемент – вода» обеспечивают отрицательное значение энергии Гиббса в течение длительного времени процесса гидратации, а различные по знаку тепловые эффекты процессов объединения нанодисперсных частиц (+) и поверхностного диспергирования зерен цемента (-), стимулируют автоколебательное течение реакций взаимодействия клинкерных минералов с водой, включая индукционный и последующие периоды гидратации цемента.
Необходимо отметить, что диспергирование частиц цемента происходит в основном за счет протонирования приповерхностных и поверхностных слоев частиц. Протоны, образующиеся при электролитическом разложении молекул воды при первичном контакте с частицами цемента и при реакции гидролиза, обладают аномально высокой подвижностью – 3,26·10-5 м/с при напряженности электрического поля 1 в/см и высокой проникающей способностью, т.к. их размеры на несколько порядков (табл. 1) меньше размеров кристаллической решетки клинкерных минералов. Протоны, перемещающиеся к поверхности частиц цемента по эстафетному механизму и проникающие в кристаллическую решетку минералов, связываются прочной связью с электроотрицательными атомами кислорода и образуют гидроксилионы. Кроме того, протоны вступают в реакции ионного обмена с катионами минералов (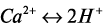 и др.) в результате чего наряду с гидроксилионами образуются аквакомплексы [Ca(H2O)6]2+, [Al(H2O)6]3+, [Fe(H2O)6]3+, и первичные молекулы Са(ОН)2, размер которых сопоставим с размерами кристаллической решетки основных минералов, и за счет этого происходит расклинивающее разрушение поверхностного слоя частиц цемента с образованием нанодисперсных гидратированных частиц. Свой вклад в процесс диспергирования частиц вносит также образование гидратированного кремнезема. Постоянное диспергирование исходных частиц цемента, образование и укрупнение гидратированных частиц в период схватывания приводит к заполнению свободного порового пространства системы «цемент – вода», возникновению стесненного состояния и избыточного давления, которые стимулируют развитие процессов перекристаллизации первичных продуктов гидратации в более стабильное состояние с плотностью 2,4-2,6 г/см3. К концу сроков схватывания на термокинетической кривой процесс перекристаллизации сопровождается значительным выделением тепла, и в это время происходит схватывание цементного теста и формирование достаточно прочного кристаллического каркаса цементного камня.
и др.) в результате чего наряду с гидроксилионами образуются аквакомплексы [Ca(H2O)6]2+, [Al(H2O)6]3+, [Fe(H2O)6]3+, и первичные молекулы Са(ОН)2, размер которых сопоставим с размерами кристаллической решетки основных минералов, и за счет этого происходит расклинивающее разрушение поверхностного слоя частиц цемента с образованием нанодисперсных гидратированных частиц. Свой вклад в процесс диспергирования частиц вносит также образование гидратированного кремнезема. Постоянное диспергирование исходных частиц цемента, образование и укрупнение гидратированных частиц в период схватывания приводит к заполнению свободного порового пространства системы «цемент – вода», возникновению стесненного состояния и избыточного давления, которые стимулируют развитие процессов перекристаллизации первичных продуктов гидратации в более стабильное состояние с плотностью 2,4-2,6 г/см3. К концу сроков схватывания на термокинетической кривой процесс перекристаллизации сопровождается значительным выделением тепла, и в это время происходит схватывание цементного теста и формирование достаточно прочного кристаллического каркаса цементного камня.
Таблица 1. Сравнительные размеры кристаллической решетки минералов и ионов
| Минерал | Размер элементарной ячейки (иона), нм | Минерал, ион | Размер элементарной ячейки (иона), нм |
| C3S | 0,5-0,7 | CaO | 0,48 |
| C2S | 1,4-2,5 | Ca(OH)2 | 0,36-0,49 |
| C3A | 1,5 | OH— | 0,306 (диаметр) |
| C4AF | 0,53-1,45 | H | 0,106 (диаметр) |
| H2O | 0,27 (радиус мол.) | H+ | 1,2·10-6 |
Содержание капиллярно-неподвижной воды (максимальная молекулярная влажность) в цементном тесте, определенное по методу влагоемких сред [4] (сжатие лепешки цементного теста с В/Ц = 0,3, толщиной 1-2 мм, помещенной между двумя пакетами фильтровальной бумаги, при давлении 6,55 МПа в течение 10 мин.), составляет в течение всего периода схватывания 12-13% и лишь к концу сроков схватывания резко увеличивается – до 17%. Этот факт также подтверждает протекание процесса перекристаллизации и свидетельствует о том, что вода в первичных гидратированных продуктах удерживается адсорбционными силами вплоть до конца сроков схватывания, и только при перекристаллизации образуются устойчивые кристаллогидратные соединения.
Увеличение плотности продуктов гидратации при их перекристаллизации приводит вновь к появлению свободного порового пространства в системе и свободной воды, которая вступает во взаимодействие с негидратированными частицами цемента, и такой цикл гидратации повторяется с затухающей интенсивностью в течение длительного времени. Исходя из этого можно сказать, что при гидратации и твердении цемента наблюдается своеобразная «перекачка» жидкости через твердую фазу, а не через жидкую, как утверждается, например, при сквозьрастворном механизме гидратации.
Процессы гидратации и твердения цемента являются глубоко взаимосвязанными, и управлять этими процессами можно лишь на основе детального анализа механизма этих процессов. Если движущей силой процесса гидратации является разность тепловых эффектов процессов присоединения воды твердой фазой и диспергирования исходных частиц цемента, то движущей силой процесса твердения является разность объемного содержания твердой фазы 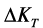 в гидратированном
в гидратированном 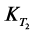 и негидратированном
и негидратированном 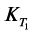 цементе:
цементе:
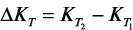 ,
,
т.к. истинная плотность гидратированных продуктов всегда меньше плотности исходного цемента. Из этого следует, что для ускорения твердения цемента необходимо интенсифицировать процесс образования первичных нанодисперсных продуктов гидратации с помощью энергетических воздействий, следующих из объединенного уравнения 1-го и 2-го законов термодинамики. В качестве примера можно назвать следующие воздействия: дополнительное механическое диспергирование исходного цемента ( ); уплотнение исходной системы «цемент – вода» (
); уплотнение исходной системы «цемент – вода» ( ); повышение неравновесного состояния клинкерных минералов (
); повышение неравновесного состояния клинкерных минералов (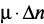 ); увеличение диэлектрической проницаемости воды и ее растворяющей способности (
); увеличение диэлектрической проницаемости воды и ее растворяющей способности (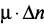 +
+ 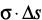 ); ускорение реакций гидролиза, приводящих к возникновению кислой водной среды (
); ускорение реакций гидролиза, приводящих к возникновению кислой водной среды (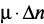 +
+ 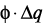 ); изменение ионного состава воды с помощью добавок солей, обладающих положительной или отрицательной гидратацией ионов (
); изменение ионного состава воды с помощью добавок солей, обладающих положительной или отрицательной гидратацией ионов (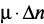 +
+ 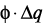 ); регулирование адсорбционных свойств гидратированной твердой фазы с помощью ПАВ (
); регулирование адсорбционных свойств гидратированной твердой фазы с помощью ПАВ (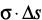 ); электрофизическое, электрохимическое и электромагнитное воздействие на систему (
); электрофизическое, электрохимическое и электромагнитное воздействие на систему (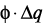 ); тепловое воздействие на систему (
); тепловое воздействие на систему (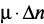 ,
,  ).
).
Из этого следует, что используя энергоинформационные воздействия составляющих энтальпийного фактора на систему «цемент – вода», можно целенаправленно влиять на интенсивность протекания не только процессов гидратации, но и твердения цемента.
Библиографический список
1. Ратинов В.Б., Розенберг Т.И. Добавки в бетон. – М.: Стройиздат, 1989, с. 29-36.
2. Бутт Ю.М., Сычёв М.М., Тимашев В.В. Химическая технология вяжущих материалов. – М.: Высшая школа, 1980, с. 340-344.
3. Фролов Ю.Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. – М.: Химия, 1989. – 464 с.
4. Ломтадзе В.Д. Физико-механические свойства горных пород. Методы лабораторных исследований. – Л.: Недра, 1990, с. 150-151.